|
FDA医疗器械510k登记什么是510(k)? 510(k)不是表格,510(k)只是一个FD&C Act的一个章节,详细描述了510(k)的要求,故此称为510(k)认证。 对于所有受510(k)管制的产品,在上市前都需要向FDA提交510(k)申请,得到FDA批准通知后才可上市售卖,此过程也称为上市前通知(PMN)。 申请人需要将自己申请的产品和通过市场已有的510k认证产品进行比较,向FDA说明自己的产品和以认证的产品实质相同的(Substantially Equivalent),是安全有效的。
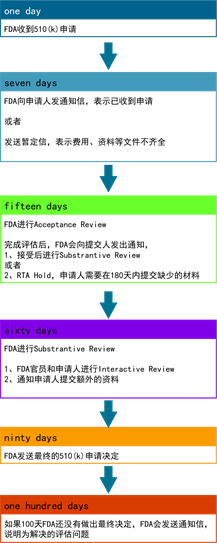
510k评估时间和流程 510k申请时间一般在8个月左右,前期申请人需要完成相应的实验项目,获得实验报告和完成510k文件的编制。提交给FDA后,FDA将会在90天内完成510K的审核,FDA的具体时间流程可以参考下图。
510k申请文件内容 1. Medical Device User Fee Cover Sheet 2. CDRH Cover Sheets 3. 510(k) Cover Letter 4. Indications for Use Statement 5. 510k Summary 6. Truthful and Accuracy Statement 7. Class III Summary and Certification 8. Financial Certification or Disclosure Statement 9. Declarations of Conformity and Summary Reports 10. Executive Summary 11. Device Description 12. Substantial Equivalence Discussion 13. Proposed Labeling 14. Sterilization and shelf life 15. Biocompatibility 16. Software 17. EMC and Safety Testing 18. Performance Testing -Bench 19. Performance Testing – Animal 20. Performance Testing – Clinical |